☆ 近10年来,FDA批准的抗肿瘤新药使用单臂试验相比随机对照试验,将临床研发时间缩短了2年。
☆ 单臂试验支持抗肿瘤新药注册时,中美监管机构一般都采用客观缓解率(ORR)作为审评终点。
☆ 肿瘤免疫药物方面开展单臂试验的热情很高,个别药物正在开展的单臂试验超过10项。
2020年5月22日,国家药监局药品审评中心(CDE)发布《关于公开征求《单臂试验支持注册的抗肿瘤创新药进入关键试验前临床方面沟通交流技术指导原则》意见的通知》。10多天后,在此基础上,6月5日CDE进一步发布了《单臂试验支持注册的抗肿瘤创新药申请上市前临床方面沟通交流技术指导原则(征求意见稿)》,征求行业意见。
通常,新药的获准上市应该建立在有充足的研究证据的基础上。近年来,为了加速罕见病以及危及生命的、缺乏可治愈手段和具有迫切临床需求的新药上市,在新药研发上采用的多种创新模式,单臂试验(single arm trial,SAT)就是其中一种。SAT无对照组,可极大加速研发时间,近10年来,FDA批准的抗肿瘤新药使用SAT相比随机对照试验(randomized controlled trial, RCT),将临床研发时间缩短了2年。
CDE近期发布的SAT支持抗肿瘤新药注册的征求意见稿着重讨论了资料准备、沟通交流会议的核心问题以及会后的要求,不过在背景部分还是简略地提及SAT的适用情况。

CDE在两份《征求意见稿》中,均未提及审评终点。不过对既往CDE和FDA的单臂试验成功注册案例进行分析后发现,单臂试验支持抗肿瘤新药注册时,中美监管机构一般都采用客观缓解率(ORR)作为审评终点。

之前,研发客对CDE杨志敏部长的采访中,杨部长也提到,单臂试验选择的临床终点观察指标一般为ORR,与疾病稳定和时间相关的评价指标如OS(总生存期)、PFS(无进展生存期)一般无法采用。此外,“对于免疫肿瘤产品还有一个特别的关注指标,即治疗后的持续缓解时间,我们希望能看到患者治疗以后长期持续缓解的结果。”

研发客对当前我国抗肿瘤新药临床试验做了初步分析后发现,国内企业目前在抗肿瘤新药,特别是肿瘤免疫药物方面开展SAT的热情很高,个别药物正在开展的SAT超过10项。
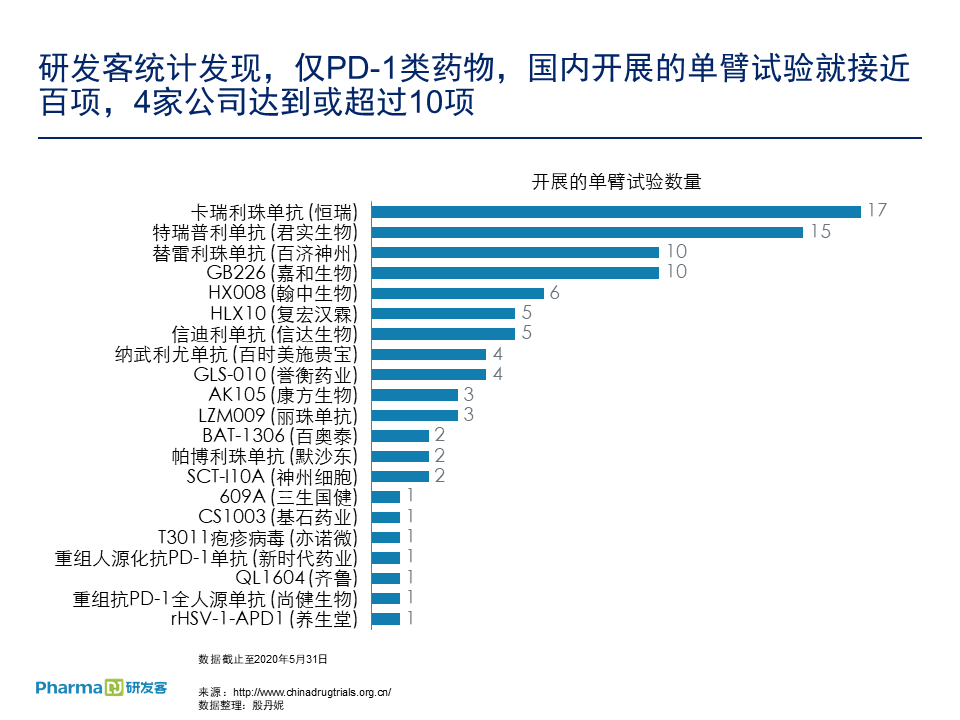
另一方面,研发客也注意到,个别企业提交的SAT临床申请被CDE拒绝。临床试验设计简单,持续时间短,获批时间快,将研发的创新药推向市场是企业的期望。如何少走弯路,做出严谨可靠的SAT临床试验设计,并以此为基础快速获得新药注册,企业需要注意些什么呢?
